Кузнецов A. E. Научные основы экобиотехнологии . Раздел 1
Кузнецов A. E. Научные основы экобиотехнологии . Страница 88
Верхний предел Eh определяется реакцией
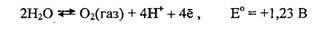
При потенциале выше +1,23 В вода окисляется с выделением кислорода.
Согласно уравнению Нернста в природных условиях, отличающихся от стандартных (Р = 1 атм или 0,1 МПа, T = 298 0C), потенциал этой реакции
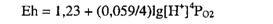
Парциальное давление кислорода в атмосфере составляет 0,2 атм (0,02 МПа), поэтому
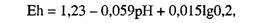
то есть
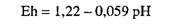
Нижний предел определяется реакцией
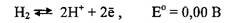
В соответствии с уравнением Нернста для этой реакции 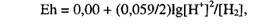
или
Eh = -0,059рН - (0,059/2)lgPH2
Нижний предел Eh возможен при давлении водорода, равном атмосферному, и описывается уравнением
Eh = -0,059рН
В качестве стандартной системы окислительно-восстановительного потенциала среды принято соотношение ионов водорода и молекул водорода. Концентрация ионов водорода в среде характеризуется рН, а концентрация молекул его - отрицательным логарифмом парциального давления растворенного в среде водорода гН2:
гН2= -lgPH2
При парциальном давлении растворенного водорода 1 атм (0,1 МПа) rH2 = 0, а при таком же парциальном давлении растворенного кислорода (что соответствует концентрации растворенного кислорода в воде 40 мг/л) гН2 = 41,2. Чем выше гН2, тем больше окислительная способность среды и наоборот. Шкала, основанная на использовании гН2, в которой значения меняются от 0 до 41,2, удобна для характеристики аэробности/анаэроб- ности среды.
Взаимосвязь между гН2, рН и Eh выражают зависимостью
rH2 = 34,5Eh + 2рН
При отсутствии кислорода, низких положительных значениях Eh (гН2) условия благоприятны для развития анаэробных процессов. Eh и рН для некоторых природных сред приведены на рис. 2.3.
В природных средах основными потенциалзадающими системами являются система кислорода и окислительно-восстановительные реакции с участием железа, серы и углерода.
