Кузнецов A. E. Научные основы экобиотехнологии . Раздел 1
Кузнецов A. E. Научные основы экобиотехнологии . Страница 86
Гидрохимические показатели воды. рН природных вод меняется в интервале от 3 до 11. Низкий рН (3,4-6,5) характерен для воды болот, а высокий (8,6-9) - для зон «цветения». рН до 3,4 характерен для сфагновых болот. рН воды сульфидсодержащих рудных месторождений может быть еще более низким. Самый высокий рН в содовых озерах (11-12). рН большинства рек и озер от 6 до 8. рН морских и океанических вод сравнительно стабильный: рН прибрежных вод около 9, средний рН воды океана выше 8.
рН в значительной степени определяет скорости миграции химически элементов и влияет на состав водных биоценозов. Рыбы выдерживают pi от 5 до 9, отдельные виды могут приспосабливаться к рН до 3,7, плотва до 10. При рН ниже 7,5 многие морские организмы погибают; особен» чувствительны к рН яйца морских животных.
рН водной среды определяется химическим составом растворенных ве ществ, составом минеральных пород берегов и дна, биотическими процес сами. Кислотность атмосферных осадков, поступающих в водоемы, Kai правило, не влияет на рН воды.
В регулировании рН воды важную роль играют карбонат-бикарбонат ная система и углекислый газ:
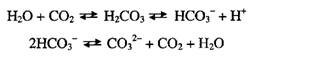
Диоксид углерода находится в виде растворенного газа CO2, часть ко торого (~1%), взаимодействуя с водой, образует угольную кислоту. Поэто му рН воды, освобожденной от солей, но соприкасающейся с атмосферные воздухом, вследствие растворения в ней углекислоты ниже 7. При равнове сии между растворенным и атмосферным CO2 устанавливается рН 5,6. Со держание CO2 в воде рек и озер колеблется в пределах 20-30 мг/л.
В пресной воде на долю карбонатов в среднем приходится 79,9% οι общего содержания солей; некоторые природные воды почти не содержап карбонатов. В присутствии Ca2+ взаимодействие между H2CO3 и HCO3" определяет буферные свойства и условия равновесия между растворенным бикарбонатом и малорастворимым карбонатом кальция:
